2023年5月23日,南京中医药大学医学院﹒整合医学学院,附属鼓楼临床医学院林炜教授课题组和浙江大学冯钰教授团队、中国科学院分子植物卓越创新中心赵国屏院士团队以及中国科学院物理所王爽研究员团队在国际著名期刊美国科学院院刊PNAS上发表了题为Structural insights into the transcription activation mechanism of the global regulator GlnR from actinobacteria的研究成果。该研究捕获了结核分枝杆菌GlnR依赖型基因转录激活复合物结构,揭示了全局性转录调控蛋白GlnR选择性调控基因转录的分子机制,为全面认识结核分枝杆菌和整个放线菌的代谢调控机制奠定了基础。该工作是林炜教授团队继Mol. Cell(2017, 2018)、Nat Commun(2019)、Nucleic Acids Res(2020, 2021, 2022a, 2022b)之后在病原菌基因转录调控机制研究和新型抗耐药菌药物靶点发现领域取得的又一项全新研究成果。

基因组遗传信息得以表达,首先需要RNA聚合酶(RNAP)以DNA为模板合成RNA。对RNAP运行机理和调控机制的研究能够回答基因表达调控的关键基础科学问题。在转录起始阶段,细菌的RNAP与转录起始因子形成复合物,依次执行启动子双链DNA识别、解链等关键步骤,多种转录调控因子通过结合转录起始复合物,选择性调控相关基因的转录。
结核分枝杆菌是兼性胞内寄生菌,其在宿主体内的存活能力是造成持续性感染的主要原因之一。针对宿主内的多种不利因素,结核菌会通过自身代谢重塑来适应和抵抗宿主体内的恶劣环境。氮代谢是生命活动过程中最基本的代谢活动。在各种生命体系中,氮代谢途径都受到了严格而灵活的调控。对大肠杆菌的氮代谢调控网络已研究的很全面,其转录调控主要由一对经典的双组份系统NtrB/NtrC负责;而结核分枝杆菌不同,其氮代谢是由孤儿应答调控蛋白GlnR负责,GlnR在氮源匮乏条件下全局性调控结核菌的氮代谢基因转录。全局性转录调控因子GlnR不仅能在氮源匮乏的情况下会选择性激活大多数氮同化基因的表达,还能协同调控菌体的碳、磷、次级代谢基因表达,全面理解结核菌在宿主体内等特殊生境下GlnR依赖型基因转录的选择性调控机制能为破解结核菌潜伏感染提供新的思路。
文章解析了结核分枝杆菌OmpR/PhoB亚家族转录调控蛋白GlnR,启动子DNA,及RNAP的复合物电镜结构。该结构揭示了GlnR蛋白如何与启动子DNA以及RNAP协同激活下游靶标基因转录。结构显示4分子GlnR的C端DNA结合结构域分别依次头尾相连排列结合在启动子DNA上,而4分子GlnR的N端调控结构域首先分别各自形成二聚体,之后二聚体与二聚体之间进一步形成同源四聚体,由4分子GlnR的N端调控结构域形成的同源四聚体在GlnR的C端DNA结合结构域与RNAP之间扮演着“分子桥梁”的作用,拉近了启动子DNA与RNA聚合酶核心酶之间的距离,稳定了GlnR依赖型转录激活复合物,促进了GlnR调控的下游靶标基因的转录。GlnR采取的这种由4分子转录调控蛋白协同激活转录的机制与之前鉴定的由2分子转录调控蛋白激活的Class I、Class II、Class III的转录激活机制完全不同(图1)。因此,该研究为全面理解细菌双组份系统(Two component system,TCS)双组份系统OmpR/PhoB亚家族应答调控蛋白调控转录的规律提供了基础,也为抗耐药结核分枝杆菌感染药物的研发提供了新的思路和靶标。
南京中医药大学为该论文的第一作者和通讯作者单位,林炜教授为该论文的第一通讯作者;史婧副教授为该论文的第一作者和共同通讯作者;硕士研究生冯贞贞为该论文的共同第一作者;本研究获得了国家自然科学基金面上项目(82072240、32270192、32270037)、青年项目(81903526、32000025);江苏省自然科学基金项目(BK20190798、BK20211302);江苏省中药资源产业化过程协同创新中心重点项目(ZDXM-2020-10);南京中医药大学中药学一流学科开放课题项目(2020YLXK008、2020YLXK016)、江苏省基础医学重点学科及教育部霍英东青年教师基金等项目资助。
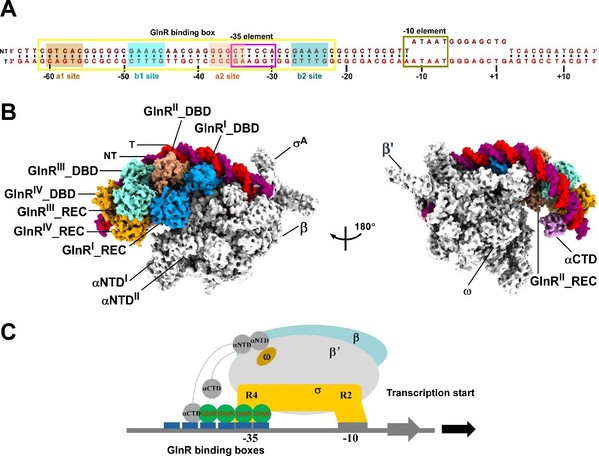
图1. 结核分枝杆菌GlnR依赖型转录激活复合物的冷冻电镜结构。 A. GlnR激活的下游靶标基因启动子DNA scaffold; B. GlnR依赖型转录激活复合物结构;C. GlnR激活下游靶标基因转录的模型。
原文链接如下:
https://www.pnas.org/doi/10.1073/pnas.2300282120
(撰稿人:林炜;审核人:关晓伟)
